| |
Абиетиновая кислота C20H30O2, молекулярный вес 302,44 – основная составная часть канифоли, из которой и получается; т. пл. 174–175°; т. кип. 248–250°/9,5 мм; [α]19D = -104,2° (C2H5OH, C = 10); легко растворима в эфире, спирте, бензоле, метаноле, ацетоне, плохо – в петролейном эфире и нерастворима в воде.
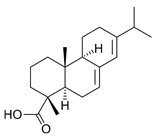
А. к. легко окисляется; термически мало устойчива, под действием S и Se, а также в присутствии на Pd угле дегидрируется в ретен; вступает в диеновый синтез с малеиновым ангидридом; сульфируется, нитруется и легко сочетается с нитрофенилдиазонием. Г. В. Кондратьева.
(Энциклопедия том 1 ст. 17)
Антимонит [< ср. – лат. Antimonium сурьма] стибнит, или сурьмяный блеск; минерал, сложенный сульфидом сурьмы (Sb2S3) с примесями висмута, золота, мышьяка, серебра; встречается в виде свинцово–серых игольчатых кристаллов, служит основной рудой сурьмы.
(Словарь иностранных слов ст. 65)
Апертура [лат. apertura отверстие] 1) действующее отверстие оптического прибора, определяемое размерами линз или диафрагмами; угловая А. – угол между крайними лучами конического светового пучка, попадающего в прибор; числовая А. – произведение показателя преломления среды (отделяющей объект от передней линзы объектива микроскопа) на синус половины угловой А.; определяет освещенность изображения и разрешающую способность прибора; 2) раскрыв антенны – излучающая или принимающая излучение поверхность сложных антенн.
Атмосфера – внесистемная единица давления; нормальная, или физическая, атмосфера обозначается атм.;
1 атм. = 101325 Па = 1013,25 гПа = 760 мм рт. ст. = 10332 мм вод. ст. = 1,0332 ат; используется также техническая атмосфера, которая обозначается – ат;
1 ат = 1 кгс/см2 = 735,56 мм рт. ст. = 104 мм вод. ст. = 98066,5 Па.
(Словарь иностранных слов ст. 95)
Вектор [лат. vector везущий, несущий] величина, характеризуемая не только числовым значением, но и направлением; представляется в виде отрезка определённой длины и направления; векторы равны лишь в том случае, если у них одинаковы длины и совпадают направления; векторы изображают т. наз. векторные величины: силу, скорость, ускорение и т.д.
Вектор. К середине XIX в. понятие вектора возникает в трудах нескольких учёных почти одновременно. Первое векторное исчисление на плоскости развил итальянский учёный Беллавитис (1835), в этом исчислении объектами операций служили отрезки. Кроме того, после публикации Гаусса «Theoria residuorum biquadraticorum» («Теория биквадратичных вычетов», 1831) получили известность работы Аргана и Весселя о геометрической интерпретации комплексных чисел. Наконец, было развито учение о кватернионах Гамильтона и опубликован труд «Ausdehnungslehre» Грассмана. В созданных Гамильтоном кватернионах
ai + bj + ck + d необходимо было различать скалярную и векторную части; таким образом, в его исследованиях появилось противопоставление скалярных и векторных величин – вместе с этими названиями. Термин «вектор» Гамильтон образовал от латинского vehere – «нести» (1845); vector – «несущий». В прочем, независимо от него выражения rayon mobile, rayon vecteure употребляли Коши (1821) и Гаусс (1809), у которых эти слова имели смысл «подвижный радиус».
Старейшее из наших обозначений – чёрточка над буквой; Арган (1806) обозначал таким образом направленный отрезок. Это обозначение, естественно, распространилось на векторы в трёхмерном пространстве. Мёбиус обозначал вектор через AB, чтобы указать его начало и конец. Грассман называл векторы «отрезками» (Strecken), он ввёл единичные векторы e1, e2, e3, направленные по осям координат, и представление вектора в виде x1e1+ x2e2 + x3e3. Общепринятые ныне i, j, k ввёл Гамильтон (1853). Максвелл обозначал векторы готическими буквами, и Хэвисайд сетовал на этот «несчастливый выбор», так как «одного этого достаточно, чтобы вызвать предубеждение читателя против векторного анализа». Вслед за Гамильтоном и Тэтом Гиббс обозначил векторы греческими буквами. Обозначение векторов жирными буквами предложил Хэвисайд (1891). Жирная печать была повторена в книге Вильсона (1901). Хэвисайд считал удачным обозначение вектора и его длины одинаковыми буквами, а также обозначение компонент вектора a через a1, a2, a3 (термин «компоненты» он перенял у Гиббса). Название «радиус-вектор» и его представление в виде 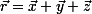 предложил Коши (1853). предложил Коши (1853).
Обозначение | AB | для длины вектора ввёл Ганс (1905). Название «модуль» родилось гораздо раньше: его образовал Арган от латинского modulus – «мера» (1814), затем его употреблял Коши. Этот термин был принят окончательно только в XX в. Гамильтон и Хэвисайд употребляли слово tensor, образованное от латинского tendo – «натягивать», «растягивать». Грассман использовал название inhaltbegriff – «величина». ...
Калия перхлорат (калий хлорнокислый) KClO4 – бесцветные кристаллы ромбической системы, a = 7,24A°, b = 8,85A°, c = 5,66A°; плотность 2,524; выше 299,5°С превращается в кубическую модификацию, a = 7,50A°; температура плавления 610°С; теплота образования ΔH°298 = –103,6 ккал/моль; трудно растворим в воде (1,8 г на 100 г H2O при 20°С); не растворим в органических растворителях. Устойчив на воздухе. Выше температуры плавления разлагается на KCl и O2. К. п. является более сильным окислителем, чем хлорат калия, и в тоже время более стоек при хранении (не взрывается от трения и удара). Получается обменной реакцией между NaClO4 и KCl. Применяется для приготовления безопасных взрывчатых веществ.
Лит.: Позин М. Е., Технология минеральных солей, 2 изд., М., 1961; ...
(Энциклопедия том 2 ст. 357)
Калия хлорид (калий хлористый) KCl – бесцветные кристаллы с кубической гранецентрированной решеткой, а = 6,290 A°; плотность 1,989; температура плавления 790°С; температура кипения около 1500°С; диэлектрическая проницаемость 4,7 (20°С); теплоемкость 0,16 кал/г/град, твёрдость по Моосу 2–2,5. Теплота образования ΔH°298 = –104,3 ккал/моль. Молекулярный вес 74,555. Растворимость К. х. в воде (в г на 100 г H2O): 28,1 (0°С); 34,3 (20°С); 40,3 (40°С); 56,2 (100°С). Криогидратная точка –10,7°С (24,6 г KCl на 100 г H2O). Насыщенный водный раствор кипит при 108,59°С и содержит 58,4 г KCl на 100 г H2O. Плотность водных растворов:
% KCl 10 20 24
d20 1,0633 1,1328 1,1623
Немного растворим в жидком аммиаке и метиловом спирте, нерастворим в большинстве органических растворителей.
К. х. встречается в природе в виде минерала сильвина. Сырьём для получения
К. х. служит природный сильвинит, представляющий собой смесь сильвина с галитом NaCl, содержащую обычно 20–40% KCl, а также минерал карналлит
KCl·MgCl2·6H2O. Получение К. х. из сильвинита основано на том, что растворимость KCl в воде значительно увеличивается при повышении температуры, в то время как растворимость NaCl с температурой изменяется мало, а при одновременном насыщении KCl уменьшается с повышением температуры. Раствор, насыщенный обеими солями, содержит при 20°С 10,4% KCl и 20,7% NaCl, а при 100°С 21,7% KCl и 16,8% NaCl. Сильвинитовую породу обрабатывают горячим щелоком, при этом KCl переходит в раствор, а NaCl остается не растворенным. При охлаждении щелока К. х. кристаллизуется, а маточник возвращается на растворение новой порции сильвинита. Можно разделить сильвинит на KCl и NaCl при помощи флотации. Получение К. х. из карналлита основано на расщеплении этой двойной соли водой или щелоком определенного состава, в результате чего MgCl2 переходит в раствор, а К. х. остается в осадке. К. х. применяется как удобрение (см. калийные удобрения), а также как исходное сырье для получения KOH и калиевых солей.
Лит.: Андреичев А. Н. и
...
(Энциклопедия том 2 ст. 360)
Керосиновая фракция – смесь углеводородов с C10– C16. В пределах 165–200°С отгоняют
уайт-спирит, в пределах 200–300°С – керосин, а в интервале 180–360°С – дизельное топливо.
(Органическая химия А. И. Артеменко ст. 113)
Объёмные силы распределены по объёму тела и приложены к каждой его частице. К объёмным силам относится вес или, например, силы магнитного притяжения.
Оксид свинца (II)
Оксид свинца PbO дает две модификации: желтую и красную. Выше 488,5°С красная модификация переходит в желтую. Следовательно, ниже 488,5°С желтая модификация находится в метастабильном состоянии.
Любой оксид свинца при нагревании разлагается и даёт оксид (II), плавящийся при 890°С. При быстром охлаждении его, образуется желтая модификация в кристаллическом состоянии. Её плавят в серебряном или корундовом тигле (в фарфоровом тигле она несколько загрязняется примесью оксидов кремния), расплавленную массу для застывания выливают на керамическую плитку. При нагревании оксидов свинца до 500°С желтая модификация получается в виде мелкокристаллического порошка.
Для образования красной модификации гидроксид свинца (II) нагревают до 140–?50°С и выдерживают при этой температуре около 0,5–1 ч. Оксид свинца (II) на воздухе устойчив.
(Практикум по неорганической ст. 176)
Осветительные составы – пиротехнические составы (см. Пиротехника), применяемые для снаряжения изделий, предназначенных для освещения местности (осветительные авиабомбы, ракеты, снаряды и др.). О. с. состоят из горючего (обычно порошок магния или алюминия, а также их сплавы или смеси), окислителя (чаще всего нитраты Na или Ba) и некоторых органических веществ, используемых в качестве связующего, для увеличения пластичности, замедления горения и др. (смолы, парафин, стеарин и др.).
Примером могут служить след. рецептуры О. с.:
1) 36% Ba(NO3)2, 6% Sr(NO3)2, 54% Mg и 4% парафина;
2) 48% NaNO3, 45% Mg и 7% связующих органических веществ;
в некоторых
О. с. может содержаться до 70% Mg. Теплота горения современных О. с. ≥ 1500 ккал/кг, температура горения ≈ 2500–3000°С.
О. с. изготовляют в специальных смесителях; перед смешением исходные материалы измельчают, сушат, просеивают; готовую смесь прессуют. При этом получаются цилиндрические изделия, запрессованные в картонные или металлические оболочки (факелы) диаметром 20–500 мм. При горении изделий образуется яркое (тысячи стильбов) белое или желтовато-белое пламя. Сила света пламени зависит от диаметра изделия, температуры и скорости горения О. с., а также от свойств продуктов горения; она колеблется в пределах 104–107 международных свечей; время горения факелов колеблется от 8 сек до 8 мин. Скорость горения спрессованных О. с. 0,5–10 мм/сек; при понижении давления (горение на больших высотах) скорость горения и свечение пламени О. с. уменьшаются. О. с. часто характеризуют значением удельной свето-суммы (L0); для современных О. с.
L0 ≥ 40·103 сек·свеч/г.
Излучение пламени О. с. гл. обр. температурное и частично люминесцентное. Температурное излучение обусловлено наличием в пламени О. с. накаленных твёрдых и жидких частиц (MgO, Al2O3, BaO и др.) и быстро возрастает с повышением температуры пламени. На О. с. по своим свойствам весьма похожи трассирующие составы и фото смеси; последние используют для снаряжения авиафотобомб (фотаб), применяемых при ночных аэрофотосъемках; сила света фотаб достигает сотен миллионов свечей, время свечения до 0,1 сек.
Лит.: Шидловский А. А., Основы пиротехники, …
(Энциклопедия том 3 ст. 786)
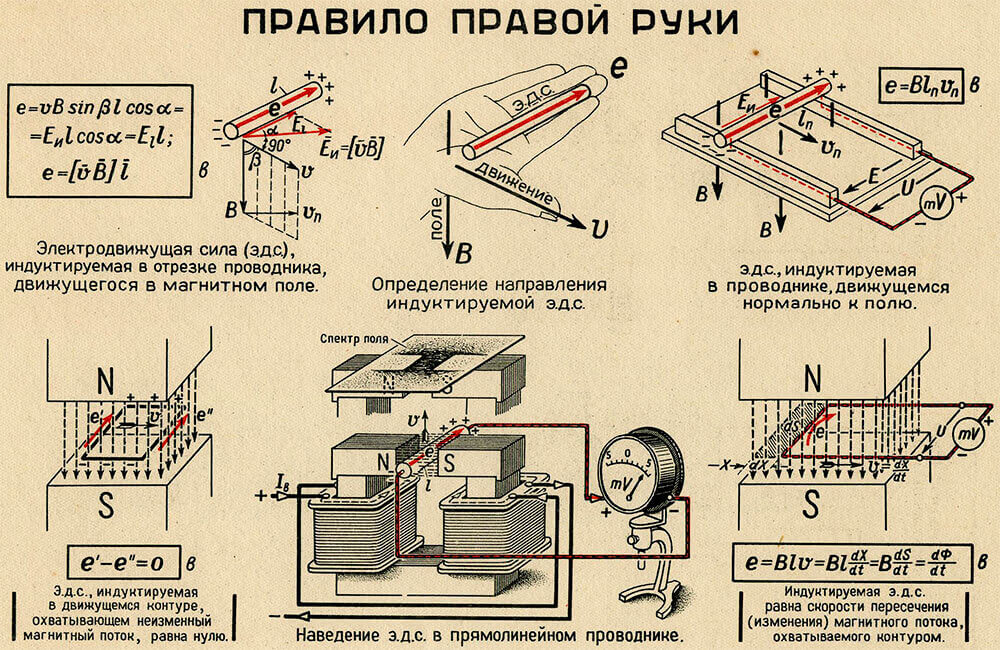
Правило правой руки.
Приготовление йодкрахмальной бумаги. 0,5 г крахмала перемешивают при нагревании со 100 мл воды до образования клейстера и прибавляют 1 г иодида калия. Полученным раствором пропитывают полоски фильтровальной бумаги шириной 4–5 см. После высушивания их снова режут на полоски шириной около 8 мм, длинной 4–5 см и хранят в банке с плотно закрытой пробкой.
(242)
Приготовление раствора соли диазония.
В стакане ёмкостью 200 мл готовят раствор 9 мл концентрированной серной кислоты в 50 мл воды. Стакан помещают в баню со льдом и солью и при энергичном перемешивании (использование механической мешалки увеличивает выход продукта.) прибавляют 7 г n–нитроанилина. Затем при постоянном перемешивании в полученную охлажденную до 0°С смесь вводят предварительно охлажденный раствор 3,6 г нитрита натрия в 7 мл воды. Нитрит натрия прибавляют через капельную воронку, отводная трубка которого доходит почти до дна стакана. Во время диазотирования температура реакционной смеси не должна превышать 10°С. После прибавления всего нитрита натрия смесь выдерживают ещё 15 мин. Окончание реакции устанавливают по йодкрахмальной бумажке.
(Лаб. работы по орг. синтезу ст. 166)
Ртути нитраты – азотнокислые соли ртути. Нитрат закиси ртути при обычных условиях выделяется в виде кристаллогидрата Hg2(NO3)2·2H2O – бесцветных моноклинных кристаллов с плотн. 4,78; т. пл. 70°С, при плавлении частично разлагаются. Теплота образования дигидрата ΔH°298 = –206,9 ккал/моль. Растворим в воде в небольших количествах, но легко гидролизуется, образуя желтую основную соль. Растворимость увеличивается в присутствии HNO3, причем такой раствор является сильным восстановителем и окисляется уже на воздухе. Конц. HNO3 окисляет нитрат закиси в нитрат окиси. С другими нитратами Hg2(NO3)2 образует комплексные соли. При обработке Hg2(NO3)2 сильными щелочами осаждается чёрная закись ртути, распадающаяся на окись и металл. Получают Hg2(NO3)2 растворением ртути в ограниченном количестве слабой азотной кислоты при температуре ниже 40°С. Используют для получения красной окиси ртути, в аналитической химии, для чернения латуни, а также в пиротехнике.
Нитрат окиси ртути Hg(NO3)2– бесцветные гигроскопичные кристаллы с плотн. 4,3; т. пл. 79°С, растворим в воде, подкисленной HNO3; при избытке воды гидролизуется с образованием основных солей, состав который зависит от разбавления. Помимо безводной Hg(NO3)2, известны многие гидраты. Получают Hg(NO3)2 обработкой ртути горячей концентрированной HNO3. Используют как исходный материал для получения других соединений ртути, для нитрования ароматических соединений, а также в аналитической химии при определении хлора в воде и при определении Th, Al, Mn, Bi, La. С. М. Мельников. ...
(Энциклопедия том 4 ст. 701)
Стопин [ит. Stoppino < stoppa пакля] огнепроводный шнур, используемый для передачи огня в пиротехнических изделиях; скорость горения на открытом воздухе 0,03–0,05 м/с.
Суверенитет [нем. Souveränität < фр. souveraineté] верховенство, верховные права; полная независимость государства от других государств в его внутренних делах и внешних отношениях.
Новейший словарь иностранных слов и выражений. – Мн.: Харвест, М.: ООО «Издательство АСТ», 2001. – 976 с. ISBN 985-13-0220-1.
Начиная с 1991 года это понятие является нежелательным для употреблении в СМИ, так как может провоцировать население России на лишние вопросы. В результате поражения в «холодной» войне Россия в значительной степени потеряла суверенитет. Управление Россией осуществляется из-за рубежа через агентов влияния. Для управления широко используются организации, финансируемые из-за рубежа. Из вне навязано, соответствующее колониальное законодательство в экономической и политической сфере. Потеря суверенитета неизбежно вызывает национально освободительное движение народов России. Поэтому для подавления воли народа применятся интенсивная алкоголизация населения, табако-курение, разврат молодёжи, наркотики и нищета. Создаются ложные идеологические течения. Однако, не смотря на такую интенсивную враждебную идеологическую обработку населения, наблюдается рост сознания людей по оценке своего реального положения. Противникам России всё труднее вербовать агентов влияния. Зависимая верховная власть России сдерживает процесс деградации населения на управляемом уровне. В этом процессе сдерживания, наблюдается заметная доля национально освободительного движения, что уже не соответствует планам внешнего руководства и приводит к жесткой внешней политике других государств по отношению к России. Необходимо отметить, что потеря суверенитета это не только проблема России, но и многих других государств. ... 24.10.2012.
Сульфит сурьмы (III)
Оксид сурьмы растворяют при небольшом нагревании до насыщения в хлороводородной кислоте, разбавленной 1:1. Не растворившуюся часть отфильтровывают и через фильтрат пропускают сероводород. Можно также в кислый фильтрат при взбалтывании отдельными порциями вливать раствор сульфита натрия:
2SbCl3 + 3Na2S → Sb2S3↓ + 6NaCl.
При этом оранжевый осадок отфильтровывают, промывают водой и высушивают при 50–60°С. На воздухе он устойчив.
(Практикум по неорганической ст. 193)
Фторопласт-4 политетрафторэтилен получают полимеризацией тетрафторэтилена CF2= CF2
n(CF2 = CF2) → (–CF2 – CF2–)n
Полимеризацию тетрафторэтилена проводят эмульсионным способом при температуре 70–80°С и давлении 4–10 ат. Процесс ведут в автоклаве, изготовленном из нержавеющей стали. Автоклав снабжён мешалкой и охлаждающей рубашкой. Инициатором реакции служит персульфат калия. Перед полимеризацией тетрафторэтилен смешивается с водой в соотношении 1:12–15. Фторопласт-4 представляет собой рыхлый порошок, хорошо прессующийся на холоду в плотные таблетки, служащие сырьём для получения изделий. При нагревании фторопласт-4 не плавится, а только размягчается. Если спрессованные таблетки нагревать 360–380°С, то они спекаются в плотную белую массу. При дальнейшем нагревании до 425°С он плавится, превращаясь в очень вязкую жидкость. При температурах выше 425°С фторопласт-4 разлагается.
Фторопласт-4 устойчив к концентрированным кислотам и щелочам, царской водке, хлорсульфоновой кислоте. При 300°С фторопласт-4 разрушается расплавленными щелочными металлами, элементарным фтором, трехфтористым хлором.
Из фторопласта-4 получают волокно продавливанием эмульсии политетрафторэтилена через фильеру с последующей коагуляцией нитей. После спекания образовавшихся нитей получают однородное волокно. Приготовленная ткань из такого волокна обладает высокой прочностью, химической стойкостью, поэтому используется для фильтрования активных коррозионных жидкостей. Фторопласт-4 сохраняет свои механические свойства до 327°С. До температуры –100°С он сохраняет эластичность. Однако при охлаждении жидким воздухом он становится хрупким. Из фторопласта-4 изготовляют уплотнительные детали ...
(Общая химическая технология ст. 284)
Хлорная известь – сложный комплекс соединений гипохлорита, хлорида и гидроокиси кальция, продукт хлорирования сухой гидроокиси кальция. Х. и. представляет собой белый зернистый порошок, в зависимости от состава более или менее гигроскопичный. Фазовый состав Х. и. колеблется в зависимости от условий образования и точно до сих пор не установлен. Будучи связанными между собой в комплексные соли, компоненты Х. и. не проявляют некоторых присущих им индивидуальных свойств. Основные составляющие Х. и.:
Ca(ClO)2·2Ca(OH)2, 3Ca(ClO)2·2Ca(OH)2·2H2O, Ca(ClO)2·3H2O, а также CaCl2·2Ca(OH)2·H2O, CaCl2·3Ca(OH)2·12H2O.
Вода растворяет основные компоненты Х. и., за исключением Ca(OH)2. Осветленный водный раствор по свойствам идентичен раствору гипохлорита кальция. При взаимодействии со стереометрическим количеством кислоты Х. и. образует хлорноватистую кислоту:
Ca(ClO)2 + 2HCl ⇔ CaCl2 + 2HClO
Избыток кислоты приводит к образованию хлора:
Ca(ClO)2 + 4HCl ⇔ CaCl2 + 2Cl2 + 2H2O
Количество хлора, выделяющегося при взаимодействии с кислотой, так называемого «активного хлора», является условным выражением окислительной способности Х. и. Содержание «активного» в Х. и. составляет 30–38%. Х. и. является сильным окислителем и переводит закиси металлов и их соли в соответствующие окисные соединения. Х. и. проявляет отбеливающие и дезинфицирующие свойства. С органическими веществами сухая Х. и. реагирует бурно, со вспышкой. Из-за распада гипохлорита кальция Х. и. весьма не устойчива. Распад усиливается с повышением влажности и температуры, при освещении, а также в присутствии тяжелых металлов. Среди возможных путей разложения гипохлоритов у Х. и. преобладает кислородный распад (см. Хлорноватистая кислота и гипохлориты). При хранении в негерметичной таре рядовая Х. и. с влажностью ~10% теряет почти весь «активный» хлор в течении года, а при температуре 40–50°С – за 2 месяца. Х. и. с содержанием влаги менее 2% более устойчива и может использоваться в тропических условиях; потери «активного» хлора при правильном хранении такого продукта не превышает 5% за 3 года.
Х. и. получают хлорированием сухой гидроокиси кальция – извести–пушонки. Процесс ведут в механических полочных камерах разбавленным (30–60%–ным) хлором. Образующаяся вода частично удаляется с отходящими газами. Сушка Х. и. может быть осуществлена при 150–200°С либо под вакуумом при 60–70°С Хлорированием пушонки во взвешенном состоянии можно получить продукт с пониженной влажностью. Х. и. применяют для отбеливания тканей и целлюлозы, в некоторых химических производствах как окислитель, а также для обезвреживания воды, дезинфекции и дегазации.
Лит.: Общая химическая технология, т. 1, М. – Л., 1952; Позин М. Е., Технология минеральных солей, 2 изд., Л., 1961; Реми Г., Курс неорганической химии, пер. С нем., т. 1, М., 1963. Б. Г. Рабовский.
(Энциклопедия том 5 ст. 709)
Этиленгликоль (этандиол) HOCH2–CH2OH – вязкая бесцветная жидкость, сладковатая на вкус. Ядовит. Гигроскопичен. t пл. = –13°С. t кип. = 197,3°С. Диэлектрическая проницаемость = 37,3. Сильно понижает температуру замерзания воды, поэтому этиленгликоль используют для приготовления антифриза (водный раствор, содержащий 25% этиленгликоля, замерзает при –12°С, а содержащий 60% – при –49°С). Этиленгликоль широко используют в химической промышленности. Так, из этиленгликоля и терефталевой кислоты получают полимер, который идет на изготовление синтетического волокна лавсан.
Артеменко. ст. 163
...
|
|